| Id |
Вид/марка |
ГОСТ |
Паспорта качества |
Примечание |
Тара |
| Id |
Тип |
| Продукты оргсинтеза |
| 3128 |
Фенол м.А, ж/д транспорт |
23519-93 |
|
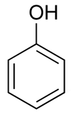 Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами: Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами:
1. при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о- и п-положениях. Эта реакция имеет очень больше практическое значение, так как лежит в основе получения важных пластических масс (бакелиты) и лаковых основ;
2. конденсация фенолов с ароматическими альдегидами лежит в основе получения некоторых важных красителей трифенилметанового ряда.
Аналитические свойства
Для обнаружения фенола используют цветные реакции, например, с раствором FeCl3 (фиолетовое окрашивание, исчезающее при подкислении), бромной водой (появление белого осадка); для идентификации фенола- кристаллические производные фенола, например, феноксиуксусную кислоту (t плавления 98-99°C). Количественно фенол определяют иодометрией, бромометрией или хроматографически.
Класс опасности - 2.
Фенол по степени воздействия на организм относится к высокоопасным веществам
Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны - 0,3 мг/м3. Максимально разовая ПДК в атмосферном воздухе населенных мест - 0,01 мг/м3, среднесуточная - 0,003 мг/м3. ПДК в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования - 0,001 мг/дм3. Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%).
При превышении ПДК возможны отравление, раздражение слизистых оболочек и ожог кожи.
Острые отравления фенолом происходят главным образом при попадании его на кожу. При общем отравлении наблюдается повышение температуры, нарушение функций нервной системы и дыхания. При хроническом отравлении - раздражение дыхательных путей, расстройство пищеварения, тошнота, слабость, кожный зуд, конъюнктивит.
Фенол кумулятивными свойствами не обладает.
Применение
Фенол - один из крупнотоннажных химических продуктов. Он широко применяется в производстве бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол; в производстве фенолформальдегидных смол; в производстве циклогексанола, используемого для получения искусственных волокон — нейлона и капрона; в производстве антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство. |
1 |
цистерна |
| 85 |
- Не указан - |
| 3129 |
Фенол м.Б, ж/д транспорт |
23519-93 |
Омский каучук (ГК Титан) (01.08.07)
|
 Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами: Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами:
1. при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о- и п-положениях. Эта реакция имеет очень больше практическое значение, так как лежит в основе получения важных пластических масс (бакелиты) и лаковых основ;
2. конденсация фенолов с ароматическими альдегидами лежит в основе получения некоторых важных красителей трифенилметанового ряда.
Аналитические свойства
Для обнаружения фенола используют цветные реакции, например, с раствором FeCl3 (фиолетовое окрашивание, исчезающее при подкислении), бромной водой (появление белого осадка); для идентификации фенола- кристаллические производные фенола, например, феноксиуксусную кислоту (t плавления 98-99°C). Количественно фенол определяют иодометрией, бромометрией или хроматографически.
Класс опасности - 2.
Фенол по степени воздействия на организм относится к высокоопасным веществам
Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны - 0,3 мг/м3. Максимально разовая ПДК в атмосферном воздухе населенных мест - 0,01 мг/м3, среднесуточная - 0,003 мг/м3. ПДК в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования - 0,001 мг/дм3. Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%).
При превышении ПДК возможны отравление, раздражение слизистых оболочек и ожог кожи.
Острые отравления фенолом происходят главным образом при попадании его на кожу. При общем отравлении наблюдается повышение температуры, нарушение функций нервной системы и дыхания. При хроническом отравлении - раздражение дыхательных путей, расстройство пищеварения, тошнота, слабость, кожный зуд, конъюнктивит.
Фенол кумулятивными свойствами не обладает.
Применение
Фенол - один из крупнотоннажных химических продуктов. Он широко применяется в производстве бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол; в производстве фенолформальдегидных смол; в производстве циклогексанола, используемого для получения искусственных волокон — нейлона и капрона; в производстве антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство. |
1 |
цистерна |
| 85 |
- Не указан - |
| 3130 |
Фенол м.В, ж/д транспорт |
23519-93 |
|
 Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами: Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами:
1. при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о- и п-положениях. Эта реакция имеет очень больше практическое значение, так как лежит в основе получения важных пластических масс (бакелиты) и лаковых основ;
2. конденсация фенолов с ароматическими альдегидами лежит в основе получения некоторых важных красителей трифенилметанового ряда.
Аналитические свойства
Для обнаружения фенола используют цветные реакции, например, с раствором FeCl3 (фиолетовое окрашивание, исчезающее при подкислении), бромной водой (появление белого осадка); для идентификации фенола- кристаллические производные фенола, например, феноксиуксусную кислоту (t плавления 98-99°C). Количественно фенол определяют иодометрией, бромометрией или хроматографически.
Класс опасности - 2.
Фенол по степени воздействия на организм относится к высокоопасным веществам
Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны - 0,3 мг/м3. Максимально разовая ПДК в атмосферном воздухе населенных мест - 0,01 мг/м3, среднесуточная - 0,003 мг/м3. ПДК в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования - 0,001 мг/дм3. Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%).
При превышении ПДК возможны отравление, раздражение слизистых оболочек и ожог кожи.
Острые отравления фенолом происходят главным образом при попадании его на кожу. При общем отравлении наблюдается повышение температуры, нарушение функций нервной системы и дыхания. При хроническом отравлении - раздражение дыхательных путей, расстройство пищеварения, тошнота, слабость, кожный зуд, конъюнктивит.
Фенол кумулятивными свойствами не обладает.
Применение
Фенол - один из крупнотоннажных химических продуктов. Он широко применяется в производстве бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол; в производстве фенолформальдегидных смол; в производстве циклогексанола, используемого для получения искусственных волокон — нейлона и капрона; в производстве антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство. |
1 |
цистерна |
| 85 |
- Не указан - |
| 4535 |
Фенол синтетический м. Б 97%, водный транспорт |
23519-93 |
|
 Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами: Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами:
1. при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о- и п-положениях. Эта реакция имеет очень больше практическое значение, так как лежит в основе получения важных пластических масс (бакелиты) и лаковых основ;
2. конденсация фенолов с ароматическими альдегидами лежит в основе получения некоторых важных красителей трифенилметанового ряда.
Аналитические свойства
Для обнаружения фенола используют цветные реакции, например, с раствором FeCl3 (фиолетовое окрашивание, исчезающее при подкислении), бромной водой (появление белого осадка); для идентификации фенола- кристаллические производные фенола, например, феноксиуксусную кислоту (t плавления 98-99°C). Количественно фенол определяют иодометрией, бромометрией или хроматографически.
Класс опасности - 2.
Фенол по степени воздействия на организм относится к высокоопасным веществам
Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны - 0,3 мг/м3. Максимально разовая ПДК в атмосферном воздухе населенных мест - 0,01 мг/м3, среднесуточная - 0,003 мг/м3. ПДК в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования - 0,001 мг/дм3. Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%).
При превышении ПДК возможны отравление, раздражение слизистых оболочек и ожог кожи.
Острые отравления фенолом происходят главным образом при попадании его на кожу. При общем отравлении наблюдается повышение температуры, нарушение функций нервной системы и дыхания. При хроническом отравлении - раздражение дыхательных путей, расстройство пищеварения, тошнота, слабость, кожный зуд, конъюнктивит.
Фенол кумулятивными свойствами не обладает.
Применение
Фенол - один из крупнотоннажных химических продуктов. Он широко применяется в производстве бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол; в производстве фенолформальдегидных смол; в производстве циклогексанола, используемого для получения искусственных волокон — нейлона и капрона; в производстве антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство. |
85 |
- Не указан - |
| 4 |
бочка 200 л |
| 1 |
цистерна |
| 180 |
танк-контейнер 25 тн |
| 4536 |
Фенол синтетический м. Б 97%, автотранспорт |
23519-93 |
|
 Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами: Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами:
1. при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о- и п-положениях. Эта реакция имеет очень больше практическое значение, так как лежит в основе получения важных пластических масс (бакелиты) и лаковых основ;
2. конденсация фенолов с ароматическими альдегидами лежит в основе получения некоторых важных красителей трифенилметанового ряда.
Аналитические свойства
Для обнаружения фенола используют цветные реакции, например, с раствором FeCl3 (фиолетовое окрашивание, исчезающее при подкислении), бромной водой (появление белого осадка); для идентификации фенола- кристаллические производные фенола, например, феноксиуксусную кислоту (t плавления 98-99°C). Количественно фенол определяют иодометрией, бромометрией или хроматографически.
Класс опасности - 2.
Фенол по степени воздействия на организм относится к высокоопасным веществам
Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны - 0,3 мг/м3. Максимально разовая ПДК в атмосферном воздухе населенных мест - 0,01 мг/м3, среднесуточная - 0,003 мг/м3. ПДК в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования - 0,001 мг/дм3. Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%).
При превышении ПДК возможны отравление, раздражение слизистых оболочек и ожог кожи.
Острые отравления фенолом происходят главным образом при попадании его на кожу. При общем отравлении наблюдается повышение температуры, нарушение функций нервной системы и дыхания. При хроническом отравлении - раздражение дыхательных путей, расстройство пищеварения, тошнота, слабость, кожный зуд, конъюнктивит.
Фенол кумулятивными свойствами не обладает.
Применение
Фенол - один из крупнотоннажных химических продуктов. Он широко применяется в производстве бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол; в производстве фенолформальдегидных смол; в производстве циклогексанола, используемого для получения искусственных волокон — нейлона и капрона; в производстве антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство. |
85 |
- Не указан - |
| 84 |
автоцистерна |
| 1882 |
Фенол синтетический технический, ж/д транспорт |
23519-93 |
Саратоворгсинтез (24.04.08)
|
 Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами: Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами:
1. при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о- и п-положениях. Эта реакция имеет очень больше практическое значение, так как лежит в основе получения важных пластических масс (бакелиты) и лаковых основ;
2. конденсация фенолов с ароматическими альдегидами лежит в основе получения некоторых важных красителей трифенилметанового ряда.
Аналитические свойства
Для обнаружения фенола используют цветные реакции, например, с раствором FeCl3 (фиолетовое окрашивание, исчезающее при подкислении), бромной водой (появление белого осадка); для идентификации фенола- кристаллические производные фенола, например, феноксиуксусную кислоту (t плавления 98-99°C). Количественно фенол определяют иодометрией, бромометрией или хроматографически.
Класс опасности - 2.
Фенол по степени воздействия на организм относится к высокоопасным веществам
Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны - 0,3 мг/м3. Максимально разовая ПДК в атмосферном воздухе населенных мест - 0,01 мг/м3, среднесуточная - 0,003 мг/м3. ПДК в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования - 0,001 мг/дм3. Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%).
При превышении ПДК возможны отравление, раздражение слизистых оболочек и ожог кожи.
Острые отравления фенолом происходят главным образом при попадании его на кожу. При общем отравлении наблюдается повышение температуры, нарушение функций нервной системы и дыхания. При хроническом отравлении - раздражение дыхательных путей, расстройство пищеварения, тошнота, слабость, кожный зуд, конъюнктивит.
Фенол кумулятивными свойствами не обладает.
Применение
Фенол - один из крупнотоннажных химических продуктов. Он широко применяется в производстве бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол; в производстве фенолформальдегидных смол; в производстве циклогексанола, используемого для получения искусственных волокон — нейлона и капрона; в производстве антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство. |
1 |
цистерна |
| 85 |
- Не указан - |
| 7096 |
Фенол синтетический технический, автотранспорт |
23519-93 |
|
 Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами: Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами:
1. при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о- и п-положениях. Эта реакция имеет очень больше практическое значение, так как лежит в основе получения важных пластических масс (бакелиты) и лаковых основ;
2. конденсация фенолов с ароматическими альдегидами лежит в основе получения некоторых важных красителей трифенилметанового ряда.
Аналитические свойства
Для обнаружения фенола используют цветные реакции, например, с раствором FeCl3 (фиолетовое окрашивание, исчезающее при подкислении), бромной водой (появление белого осадка); для идентификации фенола- кристаллические производные фенола, например, феноксиуксусную кислоту (t плавления 98-99°C). Количественно фенол определяют иодометрией, бромометрией или хроматографически.
Класс опасности - 2.
Фенол по степени воздействия на организм относится к высокоопасным веществам
Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны - 0,3 мг/м3. Максимально разовая ПДК в атмосферном воздухе населенных мест - 0,01 мг/м3, среднесуточная - 0,003 мг/м3. ПДК в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования - 0,001 мг/дм3. Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%).
При превышении ПДК возможны отравление, раздражение слизистых оболочек и ожог кожи.
Острые отравления фенолом происходят главным образом при попадании его на кожу. При общем отравлении наблюдается повышение температуры, нарушение функций нервной системы и дыхания. При хроническом отравлении - раздражение дыхательных путей, расстройство пищеварения, тошнота, слабость, кожный зуд, конъюнктивит.
Фенол кумулятивными свойствами не обладает.
Применение
Фенол - один из крупнотоннажных химических продуктов. Он широко применяется в производстве бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол; в производстве фенолформальдегидных смол; в производстве циклогексанола, используемого для получения искусственных волокон — нейлона и капрона; в производстве антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство. |
85 |
- Не указан - |
| 7509 |
Фенол синтетический технический марки А, ж/д транспорт |
|
|
|
85 |
- Не указан - |
| 7510 |
Фенол синтетический технический марки А, автотранспорт |
|
|
|
85 |
- Не указан - |
| 7316 |
Фенолсодержащая жидкая фракция, ж/д транспорт |
|
|
|
85 |
- Не указан - |
| 7317 |
Фенолсодержащая жидкая фракция, автотранспорт |
|
|
|
85 |
- Не указан - |
| 3320 |
Фенолят натрия, ж/д транспорт |
|
|
Формула: C6H5ONa
|
85 |
- Не указан - |
| 1 |
цистерна |
| 6610 |
Фильтрат технического пентаэритрита (ФТП), ж/д транспорт |
ТУ 2422-018-00203803-99 |
|
Фильтрат технического пентаэритрита (ФТП) является отходом производства пентаэритрита.
ФТП представляет собой водный раствор формиата натрия, полиспиртов (монопентаэритрита и полипентаэритрита), незначительного количества сиропообразующих веществ и других органических примесей.
ФТП предназначен для использования в качестве добавки к бетонам и растворам в строительном производстве, антисмерзителя и пленкообразующего в угольной промышленности. |
1 |
цистерна |
| 1956 |
Флотореагент ВЖС, ж/д транспорт |
|
|
|
1 |
цистерна |
| 85 |
- Не указан - |
| 2119 |
Флотореагент ОПСБ, ж/д транспорт |
|
|
|
1 |
цистерна |
| 85 |
- Не указан - |
| 1955 |
Флотореагент-кэтгол, ж/д транспорт |
|
|
|
1 |
цистерна |
| 85 |
- Не указан - |
| 7338 |
Флотореагент-оксаль Оксанол, ж/д транспорт |
ТУ 2452-015-48158319-2009 |
|
|
85 |
- Не указан - |
| 7339 |
Флотореагент-оксаль Оксанол, автотранспорт |
ТУ 2452-015-48158319-2009 |
|
|
85 |
- Не указан - |
| 7340 |
Флотореагент-оксаль Оксанол, водный транспорт |
ТУ 2452-015-48158319-2009 |
|
|
85 |
- Не указан - |
| 1953 |
Флотореагент-оксаль Т-66, ж/д транспорт |
|
|
|
1 |
цистерна |
| 85 |
- Не указан - |
| 4 |
бочка 200 л |
| 5133 |
Флотореагент-оксаль Т-66, автотранспорт |
|
|
|
85 |
- Не указан - |
| 4 |
бочка 200 л |
| 84 |
автоцистерна |
| 4701 |
Флотореагент-оксаль Т-80, ж/д транспорт |
|
|
|
85 |
- Не указан - |
| 1 |
цистерна |
| 4 |
бочка 200 л |
| 2 |
крытый вагон |
| 6783 |
Флотореагент-оксаль Т-80, автотранспорт |
|
|
|
85 |
- Не указан - |
| 4 |
бочка 200 л |
| 84 |
автоцистерна |
| 1954 |
Флотореагент-оксаль Т-92, ж/д транспорт |
|
Нижнекамскнефтехим (02.07.08)
|
|
1 |
цистерна |
| 85 |
- Не указан - |
| 4 |
бочка 200 л |
| 5134 |
Флотореагент-оксаль Т-92, автотранспорт |
|
|
|
85 |
- Не указан - |
| 4 |
бочка 200 л |
| 84 |
автоцистерна |
|
 Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами:
Фенол - при обычных условиях бесцветные кристаллы, которые, немного полежав на воздухе, приобретают розоватый оттенок. Обладает специфическим резким запахом.
Свойства
Относительная молекулярная масса - 94,11 а. е. м.
Температура плавления - 40.5 гр. C
Температура кипения - 181.7 гр. C
Плотность - 1,07 г/см3
Температура вспышки - 79 гр. C (в закрытом тигле); 85 гр. C (в открытом).
Фенол был открыт в 1834 году немецким химиком-органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол — первый член ряда фенолов (органических веществ, в состав которых входит одна или несколько гидроксильных групп, присоединенных к углероду бензольного кольца) и типичный представитель этого класса соединений.
При взаимодействии с щелочами фенол образует соли — феноляты, с общей формулой C6H5OMe:
2C6H5OН + 2NaOH = 2C6H5ONa + H2
Взаимодействие C6H5ONa с диметилсульфатом приводит к простому эфиру фенола — анизолу.
Реакции электрофильного замещения фенола протекают по орто- и пара-положениям. Так, нитрование фенола концентрированной азотной кислотой приводит к 2,4,6-тринитрофенолу (пикриновой кислоте), бромирование Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами в присутствии кислых катализаторов - к смеси о- и п-алкилфенолов.
Сложные эфиры образуются при нагревании фенола с хлорангидридами кислот в присутствии третичных аминов или с раствором NaOH (реакция Шоттена - Баумана).
Фенол (как и остальные фенолы) проявляет значительно большую кислотность, чем спирты и вода, однако как кислота он слабее, чем угольная и карбоновые кислоты. Фенол выделяется из растворов фенолятов угольной кислотой:
C6H5O-Na+ + CO2 + H2O = C6H5OН + NaHCO3
Фенол легко алкилируется при действии на феноляты галогенопроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:
C6H5ONa + C2H5Br = C6H5OC2H5 + NaBr
Фенол конденсируется с альдегидами: